文章来源:中华内分泌代谢杂志2020,36(9):751-760
作者:中华医学会内分泌学分会
通信作者:王卫庆 上海交通大学医学院附属瑞金医院内分泌代谢病科,上海市内分泌代谢病研究所,国家代谢性疾病临床医学研究中心(上海)
Email:wqingw61@163.com
为规范肢端肥大症的诊断和治疗,中华医学会内分泌学分会经专家起草,讨论完成了肢端肥大症诊治中国专家共识(2020版)。本共识采用国际通用推荐分级的评价、制定与评估(Grade of Recommendations Assessment, Development and Evaluation, GRADE)系统,对共识意见的推荐强度及证据质量进行描述。强推荐使用”推荐”和数字1表示,弱推荐使用”建议”和数字2表示。证据质量:●○○○,表示极低质量证据;●●○○,表示低质量证据;●●●○,表示中等质量证据;●●●●,表示高品质证据。通常按照”强推荐”规范进行处理利大于弊,”弱推荐”需依据患者个体情况来决定最佳方案。
肢端肥大症概况
肢端肥大症(acromegaly)作为一种隐匿起病的内分泌代谢疾病,以循环中过度分泌生长激素(growth hormone, GH)和胰岛素样生长因子1(IGF-1)为主要特征。肢端肥大症这一术语在1886年首次被使用来描述1例女性患者临床特征。95%以上肢端肥大症由分泌GH的垂体肿瘤引起,起源于垂体生长激素细胞或垂体前叶混合分泌GH及催乳素细胞;异位生长激素分泌瘤、促生长激素释放激素分泌瘤患者总数小于5%。垂体GH分泌受下丘脑激素的双重调控,促生长激素释放激素刺激GH分泌,生长抑素受体(SSTR)2型介导的生长抑素信号通路能抑制GH分泌,其他信号通路如IGF-1、类固醇激素和旁分泌生长因子也参与调节GH的分泌[1]。GH通过GH受体刺激肝脏IGF-1分泌,高水平的IGF-1促进细胞增殖,抑制细胞凋亡。垂体生长激素瘤是高度分化的生长激素细胞增殖失调,生长激素细胞合成和分泌增加引起GH表达和产生过量两方面结果。
长期过度分泌GH引起全身软组织、骨和软骨过度增生,表现为面容改变、下颌突出、手足肥大、皮肤粗厚、内脏增大、多汗、骨关节病变、腕管综合征、结肠息肉、睡眠呼吸暂停综合征、代谢紊乱和心血管疾病,心肌肥厚、高血压和心律失常常见。巨人症(gigantism)和肢端肥大症均表现为过量分泌的GH和IGF-1,青春期结束和骨骺闭合前GH升高致线性增长,发生巨人症;当GH升高出现在骨骺闭合后,则发生肢端肥大症。
致垂体生长激素瘤的分子生物学机制至今仍不明确,目前认为与编码G蛋白调节亚单位(Gαs)基因(GNAS1)和垂体瘤转化基因(PTTG)有关。约40%散发性生长激素肿瘤与GNAS1发生点突变有关,Gαs激活使腺苷环化酶呈持续兴奋状态,细胞内cAMP水平增高,使蛋白磷酸化及细胞生长和分化,导致垂体生长激素瘤发生。PTTG在正常垂体组织不表达,在体内或体外显示较强的肿瘤转化作用,提示可能导致垂体生长激素瘤的发生。
肢端肥大症大多数为散发。与遗传相关的肢端肥大症罕见,相关疾病有多发性内分泌腺瘤病(MEN)1型和4型、家族性孤立性垂体腺瘤(FIPA)、Carney综合征和McCune-Albright综合征,能促使垂体增生和肿瘤,导致肢端肥大症或巨人症。FIPA患者发病年龄较早,表现为GH分泌增加,主要由大腺瘤引起,与芳烃受体交互作用蛋白(AIP)基因胚系突变有关,15%患者存在AIP突变[2]。遗传综合征X连锁肢端肥大性巨人症(X-LAG)罕见,与早期起病的儿童巨人症相关联,Xq26.3染色体微复制导致肿瘤过表达G蛋白偶联受体基因(GPR101)。通常于出生后第1年内开始快速生长,伴垂体腺瘤或垂体增生相关的GH高分泌,常发生分泌GH和催乳素双激素肿瘤。早发性垂体增生可能与产前暴露于升高的促生长激素释放激素水平有关。需要采取多模式治疗方案,包括手术和放疗。生长抑素受体配体(somatostatin receptor ligand, SRL)效果较差,多巴胺受体激动剂降低催乳素水平,但对GH和IGF-1水平无明显效果。垂体增生患者因垂体功能低下风险无法进行广泛的手术,培维索孟可用于这类患者。国内报道的McCune-Albright综合征系列中1/4患者存在GH水平增加,其中以男性多见(76.9%)[3]。
流行病学
20世纪80和90年代研究显示,全球肢端肥大症发病率2.8~4例/百万人每年。近期报道,肢端肥大症的发病率约为10例/百万人每年,患病率40~60例/百万人每年。诊断中位年龄为40~50岁,男女发病比例无显著差异。由于发病迟缓和早期诊断困难,诊断往往平均延误7~10年。未经治疗的肢端肥大症会引起严重心血管、肺、内分泌、肾脏和肿瘤等并发症,显著缩短预期寿命[4,5]。与普通人群相比,肢端肥大症患者死亡风险增加2倍,但可通过疾病生化控制而逆转。与肢端肥大症相关的死亡可由心血管、呼吸系统和脑血管疾病所致,近年来癌症也有报道[6]。临床上诊断和治疗的延误使得并发症发生率明显增加。早期发现、早期诊断及治疗对于垂体生长激素瘤患者预后极为重要。
临床表现
垂体生长激素瘤约占所有垂体肿瘤的20%,起病隐匿,肿瘤往往生长缓慢,逐渐出现症状,早期无典型自觉症状,GH升高出现一系列典型症状和(或)体征往往需要多年时间。患者主诉多以肿瘤本身引起的症状如头痛和视野缺损来就诊,也可能首先于牙科、矫形科、风湿或心脏科求诊。
一、GH过度分泌表现
肢端肥大症患者表现为躯体和代谢变化,包括软组织肥大、骨关节炎、骨骼结构改变、器官增大和高血糖,与多种合并症如高血压、心血管疾病如心脏肥大和充血性心脏衰竭、高血糖/糖尿病、结肠息肉、甲状腺结节、腕管综合征和阻塞性睡眠呼吸暂停综合征相关。患者常出现手足感觉障碍的周围神经病,腕管综合征占20%~64%。
1.特征性外貌:
20%的患者因面部外观改变、四肢增大或两者兼有就诊。表现为前额斜长、眉弓外突、下颌前突、齿疏和咬合错位、鼻翼增厚肥大,嘴厚舌大等。
2.皮肤及软组织变化:
皮肤及皮下组织肥厚增生,足底皮肤层增厚,多汗,皮脂分泌增多,皮肤、气道黏膜及声带肥厚,音调低沉洪亮。
3.骨关节改变:
全身骨骼不同程度肥大,骨架变大,骨刺形成,软骨增生。约30%~70%的患者有关节病,出现脊柱后凸、桶状胸、关节疼痛、腰背痛、手指和足趾增宽,鞋码或戒指尺寸增大。超过60%的肢端肥大症患者存在椎体压缩性骨折。
4.糖代谢:
GH导致肝脏或外周胰岛素抵抗,15%~38%的患者出现糖耐量受损和糖尿病[7,8]。与一般人群对照组相比,患糖尿病的风险增加(危险比4.0,95%CI 2.7~5.8)。
5.心血管系统:
为最主要死因之一。高血压发生率为33%~46%,以舒张压升高更为明显,随年龄增长而增加[7,8,9]。此外,还有心律失常、心肌肥厚、心脏扩大、左心室舒张功能降低、动脉粥样硬化等表现。脂质组学研究显示,肢端肥大症患者血清磷脂酰胆碱、溶血磷脂酰胆碱水平与心脏结构和功能有关[10]。
6.呼吸系统:
60%~80%的患者存在呼吸功能障碍,可伴打鼾、憋气、嗜睡、阻塞性睡眠呼吸暂停综合征和活动后呼吸困难。阻塞性睡眠呼吸暂停综合征常见于活动性肢端肥大症,与舌咽部和上呼吸道软组织增厚和水肿有关,发生率约为69%[11]。
7.生殖系统:
男性性欲减退、阳痿,女性性欲减退、不孕、月经紊乱、闭经,可有溢乳。
8.伴发恶性肿瘤:
临床观察发现垂体生长激素瘤患者肿瘤发生危险增加,与结肠息肉及腺癌关系较密切,甲状腺结节和甲状腺癌的发生率较高[12]。
二、肿瘤压迫表现
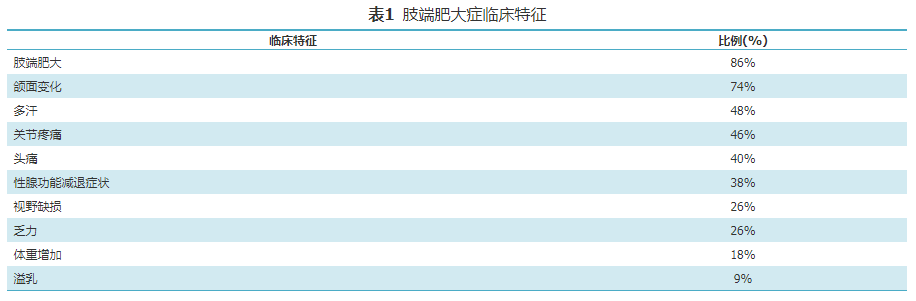
约70%患者初诊时存在大腺瘤,多伴有鞍上扩展和鞍旁侵袭。垂体腺瘤压迫、侵犯周围组织引起头痛、视野缺损(最常见为双眼颞侧半盲、单眼颞侧半盲或全盲)、眼底改变和动眼神经麻痹。肿瘤压迫还可能引起垂体功能减退。肢端肥大症临床特征见表1[13]。
诊断
一、肢端肥大症早期筛查
内分泌早期诊断与评估尤为重要,强调症状不特异时进行筛查,有利于术后长期管理。当患者无明显肢端肥大症特征性表现,但出现2个或以上下述症状时需进行筛查[14]:新发糖尿病,多发关节疼痛,新发或难以控制的高血压,心室肥大或收缩、舒张功能障碍等心脏疾病,乏力,头痛,腕管综合征,睡眠呼吸暂停综合征,多汗,视力下降,结肠息肉和进展性下颌突出。此外,近年来研究发现面部照片的深度学习有助于肢端肥大症的诊断和严重度分级[15]。肢端肥大症诊断流程图见图1。

注:IGF-1:胰岛素样生长因子1;GH:生长激素;MRI:磁共振成像;MDT:多学科团队;a:当患者无明显肢端肥大症特征性表现,但出现2个或以上下述症状时需进行筛查;新发糖尿病,多发关节疼痛,新发或难以控制的高血压,心室肥大或收缩、舒张功能障碍等心脏疾病,乏力、头疼、腕管综合征、睡眠呼吸暂停综合征、多汗、视力下降、结肠息肉和进展性下颌突出
图1 肢端肥大症诊断流程图
二、定性诊断
1.血清GH和IGF-1水平测定:
具有典型肢端肥大症临床表现,尤其是具有肢端和面容特征的患者,推荐进行IGF-1测定(1 |●●●○)。对无典型肢端肥大症表现但合并严重状态者,如睡眠呼吸暂停综合征、2型糖尿病、无力性关节炎、腕管综合症、多汗症和高血压,建议进行IGF-1测定(2 |●●○○)。有垂体占位病变患者,推荐测定IGF-1以排除肢端肥大症(1 |●●●○)。
不推荐随机GH水平用于诊断肢端肥大症(1 |●●●○)。对IGF-1水平升高或不明确的患者,推荐口服葡萄糖耐量试验(OGTT)GH抑制谷值>1 μg/L用于诊断肢端肥大症(1 |●●●○)[16,17]。通常口服75 g葡萄糖进行OGTT,分别在0、30、60、90及120 min取血测定血糖及GH水平。建议选用灵敏度≤0.05 μg/L的GH检测方法。
点评:GH刺激肝脏分泌IGF-1,其作用主要经IGF-1介导来完成。IGF-1与GH水平呈对数线性关系[18]。循环IGF-1半衰期约15 h,血清水平相对稳定,推荐IGF-1作为肢端肥大症的筛查指标。GH半衰期短,存在间歇性分泌。青春期后IGF-1水平随年龄增长而降低,其正常范围与年龄和性别显著相关,IGF-1测定结果应与年龄和性别相匹配的正常值范围(正常均值±2个标准差)进行对照,血清IGF-1高于年龄和性别相匹配的正常值范围时,判断为血清IGF-1水平升高,能反映治疗过程中疾病的活动性。IGF-1假阳性结果可能发生于妊娠期或青春期晚期。口服雌激素使肝脏对GH反应下降,致IGF-1水平降低。
2.其他垂体功能评估:
推荐进行垂体功能减退评估,对激素缺乏者进行激素替代(1 |●●●○)。
点评:建议完善垂体功能评估,对催乳素、卵泡刺激素、黄体生成激素、促甲状腺激素、促肾上腺皮质激素及靶腺激素游离甲状腺素、游离三碘甲状腺原氨酸、血清皮质醇和性激素进行测定。如有显著多尿、烦渴多饮等表现,需评估垂体后叶功能。已有腺垂体功能减退患者应做相应靶腺激素替代治疗。约30%的患者存在催乳素水平升高,可能是功能性的,也可能继发于垂体柄被肿瘤压迫,或者混合性分泌肿瘤所致,诊断区分有时较为困难。
三、定位诊断
1.影像学检查:
一旦生化确诊为肢端肥大症,推荐进行影像学检查以了解肿瘤的大小、位置、形态及侵袭性(1 |●●●○)。建议首选磁共振成像(MRI),如MRI不适用时则选择进行计算机断层扫描(CT;2 |●●○○)。
点评:垂体微腺瘤(直径<10>10 mm)于钆剂注射前T1加权显像通常为等信号,钆剂注射后呈高信号。通过MRI能进行鞍区外扩展相关分析,了解肿瘤是否存在(鞍上)向视交叉池和视交叉方向扩展,(向下)向蝶窦方向扩展,或者向侧方的海绵窦内扩展。侵袭邻近结构(特别是海绵窦)能预测是否能完整手术切除肿瘤及术后需要药物治疗。
2.视力和视野检查:
影像学检查如发现肿瘤临近视交叉时,建议完善视野检查(2 |●●●○)。
点评:大腺瘤向上延伸达到视交叉,须行眼科评估(视力及视野评估),用于评估视交叉受压情况来确认有否有紧急手术切除肿瘤的指征。
四、合并症评估和管理
建议对所有肢端肥大症患者进行相关合并症的评估,如高血压、心血管疾病、糖尿病、骨关节炎和睡眠呼吸暂停(2 |●●●○);并进行长期监测和严格管理。建议诊断时考虑结肠镜筛查结肠癌(2 |●●●○)。如触及甲状腺结节,建议进行甲状腺超声检查(2 |●●●○)。
点评:超过60%的肢端肥大症患者会出现心肌病、高血压、瓣膜病、心律失常、钠和液体潴留所导致细胞外液增加。60%患者会发生椎体骨折。骨密度不能预测肢端肥大症患者的骨折风险。骨转换指标作为骨质量的标志物,推荐在诊断时和后续随访中用于对椎体骨折进行评估。心血管和脑血管事件是肢端肥大症死亡的主要原因,通过积极治疗高血压、糖尿病、高脂血症和心力衰竭,以及戒烟、饮食以及运动行为改变来改善危险因素。25%的肢端肥大症患者因软组织和颅面骨过度生长会导致气道阻塞和呼吸并发症。推荐对症状持续的患者在肢端肥大症治疗以外,进行持续性气道正压治疗。肢端肥大症患者结直肠腺瘤性息肉与结直肠癌风险增加,诊断时可以考虑结肠镜筛查。此外,对肢端肥大症患者还需进行甲状腺疾病监测。
五、遗传分析[19]
对年轻(<30岁)肢端肥大症或巨人症患者,应考虑行AIP基因遗传分析。对家族中已有肢端肥大症或(家族性孤立性)垂体腺瘤患者,也应考虑进行AIP基因遗传分析。对2~3月龄儿童表现出生长迅速时,需怀疑X-LAG,进行Xq26.3染色体微复制的筛查。如患者或家族成员的肢端肥大症与MEN1的特征有关,如原发性甲状旁腺功能亢进、胰腺神经内分泌肿瘤和肾上腺肿瘤,应考虑行MEN1基因分析。如基因检测呈阳性,无论是AIP突变还是MEN1突变,建议对家族成员进行基因检测。
病理学评估
从组织病理学角度,肢端肥大症的病理类型包括单纯的致密颗粒型或稀疏颗粒型生长激素细胞腺瘤或混合生长激素细胞/催乳素细胞肿瘤(包括混合性生长激素细胞-催乳素细胞腺瘤和催乳素生长激素细胞腺瘤)。成人肢端肥大症最常见病因是致密颗粒型生长激素细胞腺瘤,而年轻的肢端肥大症和儿童巨人症患者最常见的是催乳素生长激素细胞肿瘤。不同类型肿瘤的临床表现、生化和影像学特征存在差异,有助于阐明其对不同治疗方式的应答。
一、单纯生长激素细胞肿瘤
单纯生长激素细胞肿瘤包括致密颗粒型和稀疏颗粒型生长激素细胞腺瘤。
1.致密颗粒型生长激素腺瘤:
存在于30%~50%的肢端肥大症患者,年龄通常大于50岁,肿瘤生长缓慢,GH和IGF-1水平较高[20,21]。由大而数量可观的嗜酸性细胞质细胞组成,细胞核趋于位于中央且呈椭圆形。免疫组化显示GH染色呈弥漫阳性。低分子量细胞角蛋白的核周染色模式与正常生长激素细胞相似,表达糖蛋白激素的α-亚基。超微结构以发育良好的粗面内质网结构、大的高尔基复合体和大量(300~600 nm)大型分泌颗粒为特征。
2.稀疏颗粒型生长激素腺瘤:
存在于15%~35%的肢端肥大症患者,表现为较快速生长的肿瘤,诊断时肿瘤直径往往较大,临床表现较易被忽视[20,21]。与致密颗粒型生长激素腺瘤相比,患者年龄较轻,更具侵袭性的生物学行为,有着较高的鞍上扩展和海绵窦侵袭发生率,多数情况下Ki67>3%。由轻度嗜酸性或嫌色性细胞组成,核偏心,有嗜酸性副核结构即纤维体。免疫组化显示,生长激素染色细胞内呈点状表现,肿瘤缺乏α-亚基表达。超微结构上可见散在的小分泌颗粒,纤维体由中间细丝和管状滑面内质网积聚而成,对细胞角蛋白呈强阳性。
T2加权MRI信号强度是颗粒化的标志,致密颗粒型腺瘤T2加权信号强度低于稀疏颗粒型腺瘤,后者SSTR2表达较低,被认为是对SRLs相对耐药的原因。有研究报道,第一代SRLs治疗失败后使用帕瑞肽治疗稀疏颗粒型腺瘤患者,其应答率更高,可能与SSTR5高表达有关。
二、混合生长激素细胞/催乳素细胞肿瘤
约30%~50%的肿瘤联合分泌GH和催乳素,导致高催乳素血症的体征和症状,包括混合性生长激素细胞-催乳素细胞腺瘤和催乳素生长激素细胞腺瘤(表2)[22]。

1.混合性生长激素细胞-催乳素细胞腺瘤:
由两种不同细胞群即生长激素细胞和催乳素细胞组成。形态学上类似于分泌GH的腺瘤,GH和催乳素免疫组化呈不同程度的染色和分布,两种细胞类型可形成小群或分散。超微结构水平上为双形态学肿瘤,由致密颗粒型或稀疏颗粒型细胞和催乳素细胞两个独立的细胞群组成。所有肿瘤细胞均表达PIT1,但只有这些细胞既表达催乳素也表达雌激素受体α。肿瘤特征取决于肿瘤细胞组成和两种细胞成分的相对比例。相比单纯生长激素细胞肿瘤,具有肿瘤体积大、缓解率较低和复发风险较高的特点,可能与肿瘤中稀疏颗粒型细胞成分有关。30%的患者往往需要联合治疗以控制病情,培维索孟、卡麦角林和SRLs使用剂量较高。
2.催乳素生长激素细胞腺瘤:
占垂体腺瘤比例小于2%,其中约8%与肢端肥大症相关,由同时表达GH和催乳素单一形态的PIT1细胞谱系细胞组成,细胞呈强嗜酸性。免疫组化染色显示,同一肿瘤细胞的细胞质内存在GH和催乳素,这一发现被双标记和免疫电子显微镜所证实。超微结构水平上,单形态学细胞群具有GH和催乳素细胞的特征,大多与致密颗粒型生长激素细胞相似,具有不同大小(200~2 000 nm)、不规则的分泌颗粒。临床和生物学特征与致密颗粒型生长激素细胞腺瘤特征相似,高催乳素血症更明显(>200 g/L),使得肿瘤在相对较小时能被较早诊断。研究发现,与单纯生长激素细胞肿瘤和混合性生长激素细胞-催乳素细胞肿瘤两种亚型相比,催乳素生长激素细胞肿瘤的体积最小,海绵窦侵袭性最低,多能全切肿瘤。
治疗
一、肢端肥大症治疗目标和治疗选择
治疗目标包括:(1)血清IGF-1水平下降至与年龄和性别相匹配的正常范围内(2 |●●○○)。(2)随机血清GH水平<1 μg/L(2 |●○○○),OGTT糖负荷后GH谷值<1 μg/L。建议在随访过程中尽可能采用相同的GH和IGF-1检测方法(2 |●●○○)[23,24]。对巨人症患者,推荐选择相同的治疗目标(1 |●●●○)。(3)消除或者缩小垂体肿瘤并防止复发。(4)消除或减轻临床症状及合并症,特别是心脑血管、呼吸系统和代谢紊乱,对合并症进行有效监控[1,25,26,27]。
点评:(1)建议通过测定GH和IGF-1水平来监测生化控制,GH<1 μg/L和IGF-1正常化与死亡风险降低相关[4,28]。血清IGF-1水平下降至与年龄和性别相匹配的正常范围内作为关键指标,是反映疾病控制的最佳指标[29]。OGTT糖负荷后GH谷值<1 μg/L最初于2000年根据术后治愈情况来定义,大型观察研究显示术后GH<1 μg/L能改善长期预后和降低死亡率[30]。采用超敏感GH检测方法时,建议OGTT糖负荷后GH切点采用0.4 μg/L[22]。该切点可能不会进一步改善代谢或显著影响达到生化缓解的比例,而更适合于新方法的检测下限[31,32]。如能达到生化控制,肢端肥大症患者致死致残风险能降低到接近一般人群水平。值得注意的是,OGTT糖负荷后GH谷值受到患者年龄、体重指数、性别和雌激素使用等多因素影响[24,33]。(2)通过手术、药物和放射治疗消除或者缩小垂体肿瘤并防止复发是治疗另一重要目的。多数研究对于SRLs治疗应答采用肿瘤体积减少20%~25%来定义显著缩小。然而,肿瘤体积测量的准确性受到影像学测量方法、肿瘤形态和观察者间差异的影响,在临床实践的常规测量中推荐采用肿瘤直径而非体积,更容易测量且足以评估有意义的肿瘤变化。(3)心血管和呼吸系统疾病是致残和致死的主要原因,而糖代谢异常进一步增加了心血管风险。建议预防和管理肢端肥大症相关的合并症,特别是高血压、心肌肥厚、糖尿病、睡眠呼吸暂停和骨病。对疾病处于活动期的患者,积极治疗和管理合并症有利于降低与肢端肥大症相关的死亡率。术后随着GH和IGF-1水平的下降,糖代谢异常、高血压、阻塞性睡眠呼吸暂停综合征等也随之改善[34]。
一旦确诊肢端肥大症,最佳治疗策略应由内分泌、神经外科、放射肿瘤学和神经影像科在内的多学科专家组成的垂体肿瘤团队进行讨论综合决定。治疗方法选择包括手术治疗、放射治疗和药物治疗(表3)。个体化治疗管理策略的制定有赖于多种数据整合,包括年龄、肿瘤大小和侵袭性、T2加权MRI特征、影响药物治疗应答的受体表达(如SSTR2、SSTR5、多巴胺2型受体D2R)、细胞周期蛋白和激素颗粒丰度等,有助于优化治疗方案,从而改善患者预后和降低经济成本。肢端肥大症的治疗流程图见图2。

注:OGTT:口服葡萄糖耐量试验;GH:生长激素;IGF-1:胰岛素样生长因子1;MRI:磁共振成像;SRL:生长抑素受体配体;a:第一代SRL治疗获部分应答[GH和(或)IGF-1下降≥50%]者,增加SRL剂量和(或)使用频率,若SRL治疗期间IGF-1轻度升高者,加用卡麦角林联合治疗;b:第一代SRL最大剂量仍未达到生化控制者:如存在不适合切除的残余肿瘤,则从第一代SRL转换为帕瑞肽治疗;存在糖代谢异常者,则换用培维索孟治疗;存在糖代谢异常且考虑残余肿瘤者,则采用一代SRL和培维索孟联合治疗
图2 肢端肥大症治疗流程图

二、手术治疗
推荐经蝶窦手术作为大多数患者的主要治疗方法(1 |●●●○)。对于微腺瘤以及局灶性生长、具有潜在手术治愈可能的大腺瘤患者,手术作为一线治疗方案。有严重急性肿瘤压迫症状(如视功能进行性下降或复视)及垂体功能减退的患者,应及早接受手术。对手术无法完整切除的鞍旁占位,建议进行手术(部分)切除以改善后续对药物治疗的反应(2 |●●○○)。手术减瘤负荷有利于提高SRLs治疗的应答反应。对初次手术后鞍内病变残留的患者,建议考虑重复手术的可能性(2 |●●○○)。
点评:推荐由有经验的神经外科医生进行手术切除。显微镜或内窥镜经蝶窦显微手术的微腺瘤初始缓解率超过85%,大腺瘤初始缓解率为40%~50%[32,35,36]。而海绵窦侵犯肿瘤可能无法通过手术完整切除。成功手术可立即降低血清GH水平,缓解肿瘤压迫。研究显示,对初次手术失败的患者进行再次手术,57%患者达到生化控制。肢端肥大症5年复发率为2%~8%[35,36]。影响手术效果的主要因素有肿瘤体积、质地和侵袭性,以及术前GH和IGF-1水平。术前GH和IGF-1水平与手术疗效呈负相关。未侵袭海绵窦且术前GH和IGF-1水平仅略高于正常的微腺瘤,手术治愈可达80%以上。侵犯海绵窦或术前GH>200 ng/ml肿瘤获得治愈的可能性小。
手术禁忌证包括拒绝手术、严重的心肌病变或呼吸系统疾病和缺乏技术熟练的外科医生。手术常见并发症包括出血、脑脊液漏、脑膜炎、水盐代谢紊乱及垂体功能减退,颈动脉损伤和视力丧失少见。
三、药物治疗
对手术切除腺瘤,疾病仍处于持续活动状态的患者,或不适合手术的患者,建议采用药物治疗。药物治疗选择包括SRLs(奥曲肽、兰瑞肽和帕瑞肽)、多巴胺受体激动剂(卡麦角林)和GH拮抗剂(培维索孟)等(表4)。

1.药物种类。
◆SRLs:95%垂体生长激素瘤表达SSTR2或SSTR5。第一代SRL包括奥曲肽(octreotide)、奥曲肽长效缓释剂和兰瑞肽(lanreotide),第二代SRL为帕瑞肽(pasireotide),主要通过与SSTR2和SSTR5结合使GH分泌减少。第一代SRLs治疗的生化控制率约55%,长效制剂报道的生化控制率较低(22%~45%)[37,38]。帕瑞肽对SSTRs亲和力的谱系范围比第一代更广。Ⅲ期试验结果显示,35%肢端肥大症患者接受帕瑞肽治疗后IGF-1正常化。该药于2014年被美国食品及药品管理局和欧洲药品管理局批准用于治疗肢端肥大症。对未接受SRLs治疗的患者,帕瑞肽长效缓释剂生化控制率高于奥曲肽长效缓释剂[38]。主要不良反应为注射部位反应和胃肠道症状,一般为轻至中度。腹部痉挛、胃肠胀气和腹泻常见,多随着治疗持续而减轻。长期使用SRLs可使胆囊淤泥或胆结石发病率增加,通常无症状,一般不需手术干预,可定期超声检测。不建议对接受SRLs治疗患者常规进行腹部超声筛查胆石症(2 |●●○○)。如有胆石症的体征和症状,应进行超声检查。少见不良反应包括脱发、心动过缓和便秘。肢端肥大症活动性减少可改善胰岛素敏感性,但由于SRLs能抑制胰岛素分泌,治疗期间会出现高血糖加重。基线HbA1C和空腹血糖水平升高是使用帕瑞肽长效缓释剂期间出现高血糖的重要预测因素[39]。使用帕瑞肽长效缓释剂治疗期间应筛查和监测血糖相关的不良反应,尤其是在治疗最初的3个月和剂量增加后的4~6个月应每周监测血糖水平。
◆多巴胺受体激动剂:包括第一代溴隐亭和第二代卡麦角林,作为轻度GH和IGF-1水平升高患者的一线药物治疗,或第一代SRL治疗的补充。多巴胺受体激动剂通过下丘脑的多巴胺受体,抑制GH释放。溴隐亭使10%~20%GH水平轻中度升高患者的GH和IGF-1水平降至正常范围。不良反应包括胃肠道不适、直立性低血压、头痛、鼻塞和便秘等。卡麦角林单药治疗生化控制率可达35%[40]。
◆GH受体拮抗剂:培维索孟(pegvisomant)是人类GH受体拮抗剂,与天然GH竞争性结合GH受体,直接阻断GH作用,致IGF-1合成减少。培维索孟阻断GH作用和降低血清IGF-1水平效率高,起效快。单药治疗生化控制率可达90%或以上,真实世界研究中接近60%[41,42,43]。培维索孟无直接抗肿瘤作用,不能降低GH,不适用于侵袭性生长的肿瘤。对接受培维索孟治疗的患者,建议选择MRI进行肿瘤大小的评估(2 |●●○○)。治疗最初6个月内建议每个月监测肝功能,随后每6个月复查1次;如转氨酶升高3倍以上,则考虑停用培维索孟(2 |●●○○)。
2.药物治疗适应证和选择。
◆药物治疗适应人群:可作为术后疾病未缓解患者的辅助治疗。一线治疗适用于:(1)预期手术无法完全切除的大腺瘤且无肿瘤压迫症状的患者;(2)不适合接受手术的患者,如全身情况较差难以承受手术风险,因气道问题麻醉风险较高,有严重肢端肥大症全身表现如心肌病、严度高血压和未控制糖尿病等;(3)不愿意手术(如恐惧手术)的患者。
◆术前药物治疗:不能为了提高术后的生化控制率而在术前常规用药(2 |●●○○)。严重咽部增厚和睡眠呼吸暂停或高输出性心力衰竭患者,建议术前使用SRLs以减少严重合并症的手术风险(2 |●○○○)。
点评:如存在手术禁忌证或手术成功可能性较低的情况下,可考虑以SRLs作为一线药物治疗方案。SRLs能控制血清GH和IGF-1水平,缩小肿瘤体积,改善临床症状和控制并发症,减轻软组织肿胀,改善睡眠呼吸暂停,减少插管相关并发症,改善心脏功能并提高麻醉安全性。
◆术后药物治疗:推荐术后处于疾病持续状态的患者接受药物治疗(1 |●●●●)。对存在严重疾病的患者(中重度高GH症状和体征,且无局部占位效应),建议选择SRLs或培维索孟作为初始辅助药物治疗(2 |●●○○)。对手术无法治愈、广泛海绵窦侵犯、无视交叉受压或无法耐受手术的患者,建议选用SRLs作为主要治疗方法(2 |●●●○)。对IGF-1轻度升高伴轻度高GH体征和症状患者,建议选择多巴胺受体激动剂(通常为卡麦角林)作为初始辅助药物治疗(2 |●●○○)。
点评:对于术后处于疾病持续状态者,推荐使用第一代长效SRL作为一线药物治疗[23]。奥曲肽长效缓释剂和兰瑞肽的选择取决于给药的实用性、方便性和患者偏好。对IGF-1轻度升高(<2.5倍正常上限)的肢端肥大症患者,选择卡麦角林作为一线治疗药物或者第一代SRL治疗的联合用药,尤其对IGF-1水平≤1.5倍正常上限者效果最好[23]。
◆药物剂量调整:建议一线药物治疗不能使IGF-1水平正常化时,启用二线药物治疗方案[23]。第一代SRL作为一线药物治疗获部分应答者[GH和(或)IGF-1下降≥50%],建议增加第一代SRL的剂量和(或)使用频率[1,23]。
点评:奥曲肽长效缓释剂起始剂量为20 mg/月,基于IGF-1和GH水平评估治疗的有效性,每3~6个月进行剂量调整,依据情况降至10 mg/月或增加至40 mg/月。兰瑞肽长效制剂的起始剂量为90 mg/月,依据情况降至60 mg/月或增加至120 mg/月。结合药物应答和患者意愿,兰瑞肽长效制剂可间隔8周给药。SRLs应答的主要预测因子包括性别(女性)、年龄、基线GH和IGF-1水平、肿瘤体积和SSTR表达。多元回归分析显示,致密颗粒型生长激素腺瘤是SRLs应答的独立预测因子。此外,T2加权MRI成像上肿瘤呈现低信号,与致密颗粒型生长激素腺瘤相关,有利于预测SRLs治疗后的肿瘤缩小[44,45,46]。接受SRLs治疗至少12个月的患者,约25%无法达到疾病控制。通过增加SRL剂量或剂量频率,至少可使额外25%患者获益。
给予第一代SRL最大剂量后仍未达到生化控制者,建议根据存在或未见临床相关残留肿瘤以及糖耐量受损的情况进行个体化治疗。如存在不适合切除的残留肿瘤,建议从第一代SRL转换为帕瑞肽长效缓释剂治疗[23,47]。对糖代谢异常和(或)接受SRLs治疗期间出现高血糖加重者,推荐换用培维索孟或加用卡麦角林作为替代治疗[23]。如二线治疗不能达到生化控制,应酌情重新考虑立体定向放射治疗(SRT)或手术干预。
点评:联合使用作用机制不同的药物,可能会起到协同作用。对SRLs治疗有部分应答的患者,联合多巴胺受体激动剂可进一步降低GH和IGF-1水平。对SRLs治疗不能充分控制且基线IGF-1水平轻度升高的患者,采用SRL联合卡麦角林能使IGF-1水平正常化>50%。培维索孟每日使用剂量范围为10~30 mg,日剂量根据需要可增加到最大剂量。培维索孟治疗期间GH水平并不下降,不以GH水平作为疗效标志来衡量,治疗过程中应定期监测IGF-1水平,以确定是否需要调整剂量方案[23,48]。培维索孟治疗反应的预测因子包括年龄、性别、体重指数、GH或IGF-1水平。年轻、男性或肥胖患者可能会比其他患者需要更高的剂量。
四、放射治疗
放射治疗是手术治疗不成功、药物治疗效果不佳或不能耐受药物治疗的三线治疗方法。术后存在残余肿瘤的情况下,如无法接受药物治疗、药物治疗无效或无法耐受的患者,建议接受放射治疗(2 |●●○○)。对无法开展放射治疗、有明显残余肿瘤负荷或肿瘤靠近视交叉致放射暴露剂量超过8 Gy的肢端肥大症患者选择SRT,而非常规放射治疗(2 |●●○○)。垂体前叶功能受损是最常见的并发症,发生率约30%,往往需要激素替代治疗。术后有残留病灶的患者,药物治疗是首选。若选择放疗,应考虑患者的年龄、生育状态、垂体功能和接受长期药物治疗的意愿等因素。
点评:放射治疗分为常规放射治疗(RT)和SRT治疗。放射治疗起效慢,对生长激素瘤获益有限。常规放疗适用于体积较大的残余肿瘤。GH水平下降缓慢,通常需要6个月至2年才能起效,部分需要5~15年才能完全发挥作用。SRT主要用于中小直径残留或复发肿瘤以及不能耐受或拒绝手术的患者,肿瘤与视交叉或视神经距离最好大于2~5 mm,以避免视力损害。SRT治疗使约50%患者能达到生化缓解。放射治疗前高IGF-1水平患者缓解率较低。
五、特殊人群
建议备孕前2个月停用长效SRL制剂和培维索孟,必要时接受短效奥曲肽直至妊娠(2 |●●○○)。妊娠期间,建议对大腺瘤患者进行连续视野监测(2 |●●●○);推荐暂停肢端肥大症药物治疗,治疗仅适用于控制肿瘤和头痛(1 |●●○○)。不建议于妊娠期间监测GH和(或)IGF-1水平(2 |●●●○)[1]。
肢端肥大症监测和并发症随访
术后除影像学随访外,激素水平监测必不可少,包括GH和IGF-1的监测。建议至少术后12周以上再进行IGF-1和随机GH测定(2 |●●●○),能有效反映手术的缓解情况[1,23,49,50]。对GH>1 μg/L患者进一步行OGTT糖负荷后GH谷值水平的测定(2 |●●●○)。
点评:手术应激可能会干扰术后即刻GH水平的判定,由于GH和IGF-1半衰期不同,使得IGF-1水平下降往往迟于GH。如IGF-1水平下降但未降至正常,则需重复进行IGF-1测定以排除检查方法学的变异性。血清GH<1 μg/L提示疾病受到控制且死亡风险正常化。
推荐至少术后12周进行影像学评估,了解有无残余肿瘤和邻近组织结构(1 |●●●○)。建议进行MRI扫描,如MRI存在禁忌证或不适用则可进行CT扫描(2 |●●○○)。对术前存在视野缺损的患者,应重复视野检查。对接受放射治疗的患者,推荐每年进行垂体功能评估,是否存在垂体功能低下和其他延迟放射效应(1 |●●●●)。
建议按特定时间间隔评估肢端肥大症的合并症。术后6个月随访内容需包括血压、空腹血糖、HbA1C和血脂水平。每年随访内容包括心电图、超声心动图、血管超声、性激素等。术后2~3年随访,如存在骨质疏松的危险因素或症状,行双能X线骨密度仪、胸部及腰椎X线检查。10年随访可考虑结肠镜检查,如初次结肠镜检查发现腺瘤,和(或)存在持续升高的IGF-1水平,则每3~5年检查1次。当疾病处于活动状态时,应积极管理合并症以减少死亡风险。当GH和(或)IGF1恢复正常后,每6个月随访是有必要的。
本指南参与编写专家名单(按姓氏笔画排序) 王卫庆[上海交通大学医学院附属瑞金医院内分泌代谢病科,上海市内分泌代谢病研究所,国家代谢性疾病临床医学研究中心(上海)];宁光[上海交通大学医学院附属瑞金医院内分泌代谢病科,上海市内分泌代谢病研究所,国家代谢性疾病临床医学研究中心(上海)];全会标(海南省人民医院内分泌科);刘伟(上海交通大学医学院附属仁济医院内分泌科);苏恒(云南省第一人民医院内分泌代谢科);李延兵(中山大学附属第一医院内分泌科);李益民(复旦大学附属华山医院内分泌科);谷卫(浙江大学医学院附属第二医院内分泌科);周薇薇[上海交通大学医学院附属瑞金医院内分泌代谢病科,上海市内分泌代谢病研究所,国家代谢性疾病临床医学研究中心(上海)];焦凯(空军军医大学唐都医院内分泌科);谢作玲(东南大学附属中大医院内分泌科)
参考文献 (略)
